自20世纪90年代以来,细胞与基因治疗领域的相关研究呈现持续上升的趋势,此领域的研究关注度逐渐提升。尤其自2017年首个CAR-T疗法产品Kymriah问世以来,CGT行业产出不断增速。
据统计,2021年细胞和基因治疗市场规模为49.9亿美元,预计到2027年将达到369.2亿美元,在预测期内以39.62%的复合年增长率增长。
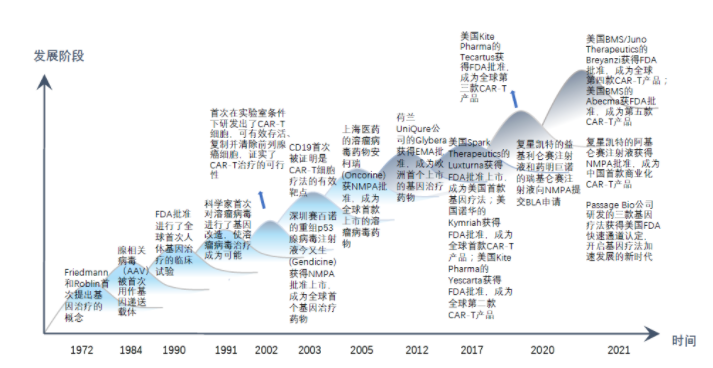
 40年砥砺发展23款CGT已获批上市
40年砥砺发展23款CGT已获批上市虽然CGT是一个新兴的医学领域,但它并不是一门新科学。早在1960年代,美国遗传学家HowardTemin(1975年诺贝尔生理学或医学奖得主)在对劳式肉瘤病毒的研究时发现病毒可以把遗传物质带入细胞并稳定地遗传下去,理论来说就可以使用病毒作载体将任意基因带入细胞,从而对缺陷细胞进行根本上的治疗。1972年,基因治疗概念被提出。
然后,在1980年代,基因工程和基因转移被确立为一种可行且安全的替代传统治疗癌症和其他生物疾病的途径。
再随着疗法在1990年代和2000年代初期的发展和普及,临床试验中出现了挫折(1999年18岁的美国男孩JesseGelsinger参与了美国宾夕法尼亚大学基因治疗项目并接受腺相关病毒载体注射,4天后,男孩因多器官衰竭死亡。)从而暴露了细胞和基因疗法的潜在危险。
最后,细胞和基因疗法上市花了40多年。
图片来源:沙利文分析
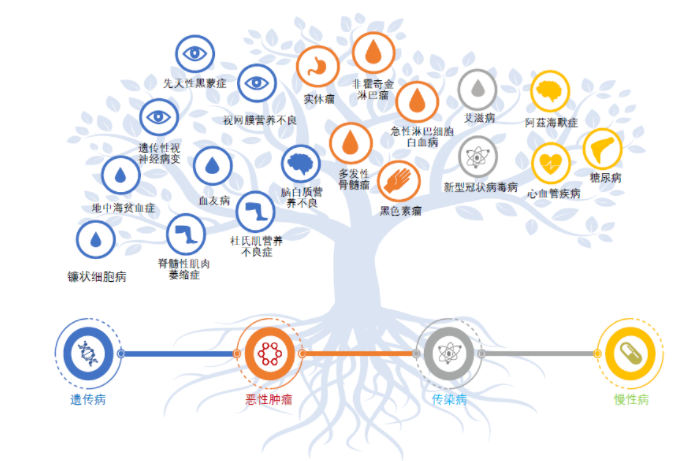
从原理即可得知,多数CGT直接靶向DNA,不同于传统的化药和生物大分子药以蛋白质为靶点。因此,针对部分无药可医的严重、罕见遗传疾病,在传统药物仅能治疗但不能治愈的情况下,CGT疗法有着治愈这些疾病的潜力,有望实现一次治疗、终身痊愈的目的。
图片来源:沙利文分析
根据FDA对于CGT产品的分类,细胞与基因治疗也可以分为质粒DNA、病毒载体、细菌载体、基因编辑系统和体外编辑细胞产品。
目前,美国FDA已批准的CGT产品共有23个,其中8个是基因治疗产品。
1)质粒DNA:通过基因工程改造过的环状DNA分子可以携带治疗基因,进而导入人体细胞中。
2)病毒载体:由于病毒天生具有能传递遗传物质到哺乳细胞中的能力,因此一些基因治疗产品由病毒衍生而来。通过修饰可以去掉病毒引起传染病的能力,使病毒可以被用作载体来携带治疗基因进入人体细胞中。
3)细菌载体:和病毒类似,细菌也可以通过修饰去掉其能引起感染疾病的能力,然后作为遗传物质的载体将其递送入细胞中。
4)基因编辑系统:基因编辑系统不同于病毒载体只能介导基因的增补,其能作为一把基因剪刀发挥强大的功能,包括基因增补、基因删除、甚至对基因进行精确的校正。
5)体外编辑细胞产品:从病人体内获得细胞,经过遗传修饰后再回输回病人体内的一种治疗模式。在癌症的CAR-T治疗中应用尤为广泛。
监管体系成熟CMC要点在哪儿?说回前文,CGT发展经历漫长的40年,从万众瞩目到冷板凳再到重获新生,这其中也促成了监管体系的成长。
目前,美国对于CGT的监管已进入规范发展阶段,形成了由法律、法规、管理制度与指南组成的相对完善的监管体系。
在FDA监管文件中CMC部分与非临床和临床部分一起,是构成IND或BLA的一个组成部分。CMC部分包括药物物质和药物产品的生产过程、过程控制、产品质量检测、规格和稳定性研究的摘要。本文将重点介绍在开发和监管提交期间需要管理的一些关键CMC问题。
为什么CMC对细胞和基因治疗的发展很重要?CGT产品的固有特性,如保质期短(自体)、使用新技术、复杂的特性和作用机制未知(MOA),给CMC的开发带来挑战。
此外,复杂的制造工艺和复杂的供应链/物流,以及加速的产品开发时间表,都促成了赞助商可能面临的CMC障碍。俗话说:过程就是产品,这句话适用于传统的生物制品,而对CGT的开发则更为贴切。
CMC在CGT开发中的重要性从申办者在监管审查期间收到的更多CMC信息请求(IRs)中可见一斑。一些CGT产品因CMC相关问题而延迟上市的消息也凸显了在开发初期做好CMC的重要性。
同时,出于CGT的突破性和“再生医学先进疗法”的地位,CMC也常常面临着被迫加速的局面。但是突破、创新并非合规取舍的借口。
FDA表示,到CGT研究的第2阶段,对产品表征和cGMP合规性的期望越来越高。对于执照,需要完全遵守所有适用的法规。FDA对后期产品开发的期望包括:
有足够的制造经验来缩小接受范围
受控的制造过程和未来扩大规模的规划
生物学相关的效力测定
并且,FDA于2020年1月发布了CMC制造指南。这涵盖了CMC对早期和后期产品开发的期望,以及通过FDA加速产品开发。
CGT研究CMC面临了哪些挑战?其实CMC挑战由多方因素造成,主要有:
1)起始材料和辅助材料的可变性和质量;
起始材料的可变性和质量是一个常见的问题,特别是在自体CGT中。在自体CGT中,起始材料来源于患者。变异性源于多种因素,包括患者疾病状态、先前治疗状况、年龄和健康状况。
制造过程中使用的辅助材料的可变性、可用性和质量是所有CGT产品(包括自体和异体)的问题,即所谓的“Garbagein,garbageout”。研究者经常面临供应有限、批次间差异以及重要辅助材料的质量问题。
除此之外,起始材料还存在许多其他挑战,包括使用动物源性材料的潜在变异性和风险,使用仅用于研究的材料,例如标记为“非临床使用,仅用于研究目的的生长因子”,而且许多原材料缺乏简单的表征测试。
2)制造工艺;
CGT产品的制造过程工艺通常比其他产品类型更复杂,由于步骤繁多而具有更高的污染风险。制造过程中的挑战包括有限的制造经验、复杂的供应链、规模缩小或扩大以及细胞库的资质和稳定性。
3)过程和产品控制。
过程和产品质量控制方面的挑战包括但不限于复杂的分析程序、快速测试的建立、用于过程和分析开发的有限材料可用性、缺乏参考标准、有限的产品表征和产品稳定性数据以及固有的产品可变性。
如何解决问题与挑战?因此,申报者首先应建立材料鉴定和管理系统,以减轻与起始材料和辅助材料相关的可变性、可用性和质量问题。对于供体起始材料,与临床人员密切合作以建立和验证单采SOP并为单采人员提供适当的培训将有助于改善单采产品质量问题。
其次,针对制造工艺的挑战,进行过程监控和渐进式制造开发对于确保制造变更管理非常重要。然而,由于起始材料的复杂性和可用性增加,CGT工艺加剧了这个问题。那么,通过使用在早期开发中识别和使用的适当缩小规模来增加批次数量,从而获得改进。
对于过程和产品质量控制,建议申报者在早期CGT产品开发中应加大分析方法开发力度。申报者应该是在开发早期探索多个关键质量属性(CQA)。在可行的情况下,规范接受标准应基于健康的供体和患者材料。此外,申报者应在开发早期建立包括运输控制策略在内的物流,以确保产品的稳定性和及时交付。
值得特别注意的是,在整个CGT开发过程中,与监管机构进行早期和及时的讨论非常重要。申报方应利用INTERACT、IND前会议和期末会议,在产品开发的整个生命周期内寻求建议并与机构保持一致。监管机构对产品开发策略的反馈对于赢得产品批准非常有帮助。IND前会议可以成为理解和协作的来源,可以在开发过程的早期极大的改善CMC的工作。在指南未涵盖某些问题的情况下,监管机构可以帮助那些表明他们意识到潜在的知识差距并渴望解决这些问题的公司。
总结种种数据表明,细胞与基因治疗行业前景广阔,是加速崛起的黄金赛道。但是细胞与基因治疗的技术的壁垒、工艺开发难度、法律法规监管、产业化等因素,使其对CRO/CDMO有更高的需求,也正因此为细胞与基因治疗CDMO的快速崛起助了一臂之力。相互成就,践行对患者的承诺,共同开发出造福患者的好药。



