近年来,癌症已成为人类健康的“头号杀手”,用药需求不断扩大。肿瘤领域似乎也成了各大药企研发布局的必选项。
但肿瘤领域也是未来竞争最激烈的领域,药物更新迭代的速度也许会超出现在很多人的认知。是继续加大投入在热门领域谋得一席之地,还是专注于自身优势领域?这是一个值得思考的问题。
日前,卫材公布了其全球架构调整的决议,将其全球研发(R&D)组织从以前的业务集团结构改革为新的研发组织DHBL(Deep Human Biology Learning,人类生物学深度学习)。
几天后,卫材决定永久关闭其肿瘤学部门H3 Biomedicine,裁员人数预计为88名,其中有79人将在9月15日之前完成裁撤。据FierceBiotech 报道,肿瘤部门的工作将在DHBL部门继续进行。
4款产品已进入临床卫材仍决定关闭H3 BiomedicineH3 Biomedicine成立于2010年,专注于利用其集成数据科学、人类生物学和精准化学发现引擎,发现和开发精准肿瘤治疗方法。
目前已有4款产品进入临床开发阶段。主要候选药物 H3B-6545是一种小分子选择性雌激素受体共价拮抗剂,用于治疗患有雌激素受体α突变的乳腺癌患者,目前已经进入临床二期。此外还有其他几款针对肝癌、膀胱癌、实体瘤及血液瘤的产品。
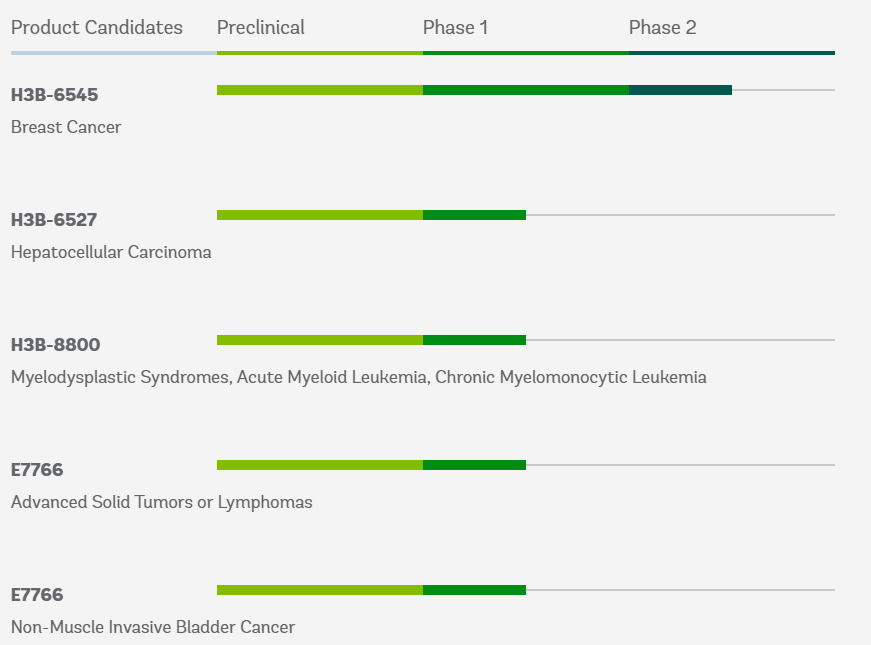
H3 Biomedicine产品管线
来源:H3 Biomedicine官网
去年8月,H3还聘请了前百济神州全球开发运营高级副总裁Ross Pettit担任业务运营副总裁。短短数月后,卫材已决定关闭 H3。
2022年7月15日,卫材宣布了新的组织架构DHBL(Deep Human Biology Learning,人类生物学深度学习),计划于2022年于10月1日启动。在此之前,神经病学事业群、肿瘤事业群、药物开发中心和 hhc 数据创建中心将被解散。而H3 Biomedicine的关闭,也正是该庞大计划的一部分。
卫材解释称,在DHBL新药发现和开发下,疾病将被视为疾病连续体,将综合分析疾病根源相关的基因信息、病理生理信息和临床信息。卫材将通过更深入的人类生物学习,基于患者的生物标志物和医学影像的信息,利用AI等其他技术,更加高效、创新地发现下一代药物。
另一方面,卫材表示,阿尔兹海默病和相关脑疾病的疾病修正疗法(DMT)相关的研发、监管、医疗、价值、准入、营销和联盟管理功能,其中下一代阿尔兹海默病治疗药物lecanemab,是其最重要的项目。
全力押注神经疾病领域卫材能否翻盘?卫材制药总部位于日本东京,是日本五大制药巨头之一。
早在1996年,卫材就推出了阿尔茨海默病经典治疗药物盐酸多奈哌齐,并联合辉瑞和强生两大巨头,将该药打造成为“爆品”。此后数十年来,卫材一心押注CNS药物研发。
2021财年年报显示,其四款销售额最高的主要产品中,有两款属于神经疾病领域——Fycompa和Dayvigo,销售额分别为319亿日元(约合15.7亿元)、164亿日元(约合8.09亿元)。
卫材商业化上市产品
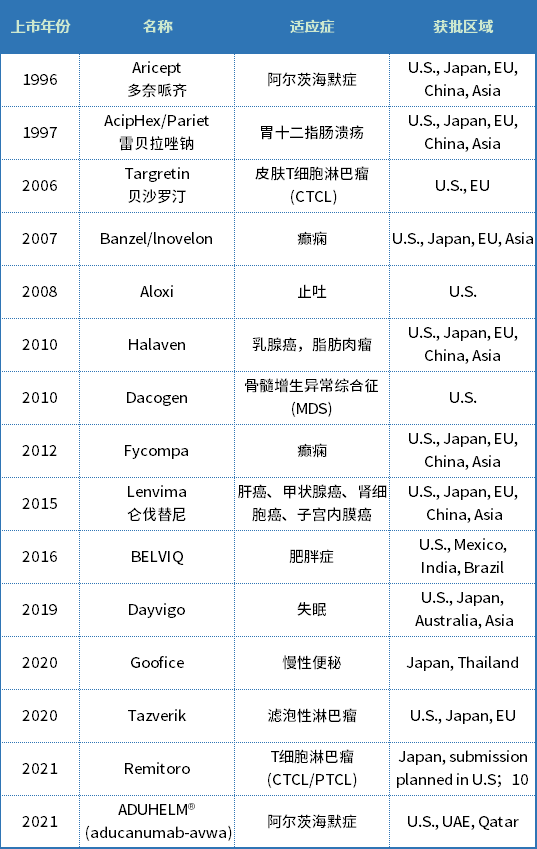
资料来源:卫材
在推出多奈哌齐二十余年后,卫材于去年又推出了Aduhelm,用于治疗早期阿尔茨海默病。不过这一次卫材没有那么好运了,Aduhelm的获批备受争议,且没有实现预期的销售额。
但Aduhelm的风波,并未影响渤健与卫材合作的另一款阿尔茨海默病疗法lecanemab的研发。
日前,卫材和渤健宣布,美国FDA已授予其阿尔茨海默病在研疗法lecanemab优先审评资格,PDUFA日期为2023年1月6日。该药去年6月曾获FDA突破性疗法认定,被卫材寄予厚望。
lecanemab与Aduhelm作用原理类似,是一种治疗阿尔茨海默病(AD)的人源化单克隆抗体。lecanemab可选择性结合中和并消除可溶性、毒性Aβ聚集体(原纤维),这些聚集体被认为加速AD的神经系统变性进程。因此,lecanemab可能对疾病病理机制产生影响,并延缓疾病进展。
lecanemab的生物制品许可申请是基于lecanemab在概念验证IIb期临床试验,开放标签扩展研究中的临床、生物标志物和安全性数据,和正在进行的III期临床试验的未揭盲安全性数据。IIb期临床试验数据显示,lecanemab降低大脑淀粉样蛋白斑块水平。在接受治疗18个月后,lecanemab(10mg/kg,每两周一次)将大脑淀粉样蛋白水平平均降低0.306SUVr单位(基线值为1.37)。超过80%的参与者达到视觉评估扫描图像时淀粉样蛋白阴性标准。同时,淀粉样蛋白降低的水平与多项认知评分的临床下降速度减慢具有相关性。此外,正在进行中的治疗早期AD的III期临床预计将在今年秋天获得主要临床终点数据。
除了lecanemab,卫材还有多款神经疾病领域产品也值得关注。
Lemborexant(Dayvigo)是卫材自主研发的一种小分子食欲素(orexin)受体拮抗剂。其两项针对成人失眠患者的关键性3期研究(SUNRISE 2和SUNRISE 1)结果显示:与安慰剂相比,在主观和客观评价方面,lemborexant均显示出在入睡和睡眠维持方面的统计学显著性优势。因此,Dayvigo在2019年获得美国FDA批准,成为首个在关键研究中有12个月治疗安全性数据和6个月入睡和睡眠维持疗效数据的失眠药物。
Fycompa(吡仑帕奈)是由卫材研发的一种新型抗癫痫药物,是一种高选择性、非竞争性的AMPA受体拮抗剂。目前,吡仑帕奈已在70多个国家和地区获批上市,包括日本、美国、中国、以及欧洲和亚洲的其他国家,作为12岁及以上癫痫患者的部分性癫痫发作(伴或不伴继发性全面性癫痫发作)的辅助治疗。此外,吡仑帕奈在全球范围内获批的适应症还包括:12岁及以上癫痫患者原发性全身强直-阵挛发作辅助治疗、单药治疗和辅助治疗4岁及以上癫痫患者的部分性癫痫发作(伴或不伴继发性全面性癫痫发作)。卫材还在全球范围内进行一项III期临床研究(研究338),意在将该药用于治疗与林-戈(Lennox-Gastaut)综合征相关的癫痫发作。此外,卫材注射制剂的开发也在进行中。
Lorcaserin (Belviq)是一种选择性血清素5-羟色胺2C(5-HT2c)受体激动剂。其原本由美国制药公司Arena研发,于2012年经FDA批准用于BMI≥27kg/m2的成人肥胖或超重患者,后来卫材与Arena签署了独家许可协议,获得了Lorcaserin在全球大多数国家和地区的商业化权利。不过,2020年,由于临床试验显示癌症发生率增加,FDA要求停用lorcaserin。然而,与此同时,lorcaserin在治疗儿童慢性重度癫痫(Dravet综合征)方面取得了进展。目前lorcaserin针对Dravet综合征这一适应症的3期研究正在进行中,FDA已授予其针对该适应症的孤儿药资格。
结 语近年来,免疫疗法等新技术的出现让抗肿瘤治疗取得了长足进步,各类新药竞相登场。但抗肿瘤新药研发风险大、激烈竞争等问题也不容忽视。
在今年的ASCO大会上,辉瑞的全球首个上市的CDK4/6抑制剂哌柏西利临床数据不理想,未来在全球竞争时面对诺华的瑞波西利和礼来的阿贝西利时将处于不利地位。罗氏TIGIT失利让多款TIGIT靶点新药蒙上阴影。而第一三共和阿斯利康的Enhertu则因为临床数据优异,可能将深刻影响乳腺癌的治疗,同时对于后续药物的开发及以上一代ADC药物为“模板”设计的药物可能造成非常致命的打击。
肿瘤领域早已是红海竞争,风险高,生命周期不确定,或许已不是“内生式增长”企业的最佳选择。
而对于一些更新缓慢的领域,例如阿尔兹海默症赛道,近年来除了卫材的Aduhelm和国内的九期一,数得上名字并被市场认可的新药基本上绝迹江湖。卫材凭借在神经疾病领域的深厚积累,或许真能打破阿尔茨海默病新药僵局,成就新的辉煌。


